当研究室は、患者さんの診療のために顕微鏡を見ている間に思いついた着想を基に、患者さんの診療のブレイクスルーにつながるリアリティーのある疾患研究を目指しています。私達自身で病理診断を行った諸臓器がんの病理組織検体等を高い品質を保って収集し、エピゲノム解析を主体とする多層的オミックス解析を展開します。これにより、がん等の疾患発生の分子機構を解明し、がんの生物学的特性がいかに決定されるかの理解を進めます。発がんリスク診断・がんの早期診断・病態診断・予後診断・コンパニオン診断法を開発するとともに、がん予防・治療の適切な分子標的候補を同定することを研究の目的としています。
当研究室は2015年6月まで国立がんセンター研究所病理部 (改組後は国立研究開発法人国立がん研究センター研究所分子病理分野)にあり、2015年7月1日の金井の慶應義塾大学への赴任とともに、信濃町キャンパス東校舎・ミュージアムに実験室をセットアップしました。国立研究機関にあっては、“がんの罹患率と死亡率の激減”を目指したミッション性のあるがん研究に従事し、他の多くの民間企業 (産)・全国の大学 (学)・国公立研究機関 (官)と共同で研究を進めてきました。このような経験を踏まえて、自ら専門とするエピゲノム解析に加え多層オミックス統合解析を実現し、その成果を実際に患者さんに届けられる形に仕上げるために重要な、産学官連携研究に努めています。
当研究室が従来から精力的に行ってきたのは、多段階発がん過程 (特に前がん段階)におけるエピゲノム異常の意義の解明です。1995年頃には“がんは遺伝子 (遺伝子変異により起こる)の病気”と理解されていましたが、金井は、「ジェネティック機構 (不可逆的な遺伝子変異)のみでは、顕微鏡で毎日観察しているがんの多様性を充分には説明できない」と考えました。そこで、当時ほとんどの研究者がエピジェネティクスの発がんへの関与を無視する中で、世界的な研究の動向に先駆けて、発がんのエピジェネティック機構 (特にDNAメチル化異常)に着目しました。
具体的には、DNAメチル化を受けるがん抑制遺伝子がRb・VHLのみしか知られていなかった当時、ヒトのがんにおいてCDH1がん抑制遺伝子がDNAメチル化とヘテロ接合生喪失 (LOH)の2ヒットで不活化される事実を初めて報告しました (Proc Natl Acad Sci USA, 92: 7416, 1995)。肝細胞がんに対する前がん段階と理解される肝炎ウイルス感染を伴う慢性肝炎・肝硬変症を呈する肝組織に、DNAメチル化異常は既に高頻度に起こっていることを報告しました (Jpn J Cancer Res, 87: 1210, 1996)。これは、肝細胞がんに対する前がん段階におけるDNAメチル化異常に関する世界でも最も早期の報告の一つでした。当時の研究者の多くは、非がん部に異常があるはずはないと思い込んでいたので、前がん段階で検出されたDNAメチル化をアーティファクトと捉え、臨床病理学的な意義を検証しようとせず黙殺していたのだと推測します。このため、金井が前がん段階でのDNAメチル化異常の意義を提唱した際には異議を唱える研究者もいましたが、これを論破するため諸臓器がんの病理組織検体を使ったDNAメチル化異常の解析を積み重ねました。
その時々に最も適切な解析手技を採用し、最近ではゲノム網羅的DNAメチル化解析 (メチローム解析)を行っています。ウイルス等の持続感染等を伴う慢性炎症や喫煙等の背景要因を伴う諸臓器の前がん状態・前がん病変において、DNAメチル化異常が好発することを報告しています。前がん段階で起こったDNAメチル化異常ががんに継承され、がんの臨床病理像や症例の予後を規定することを示しました。前がん段階で起こったDNAメチル化異常は、DNAメチル化酵素DNMT1が担う維持メチル化機構で維持され、“発がん要因への曝露の痕跡”としてゲノム上に蓄積していきます。DNAメチル化プロファイルは、その患者さんにおける“多段階発がんの歴史の記録”のようなもので、発がんの分子機構の理解に特に重要と考えて現在も研究を進めています (図1)。
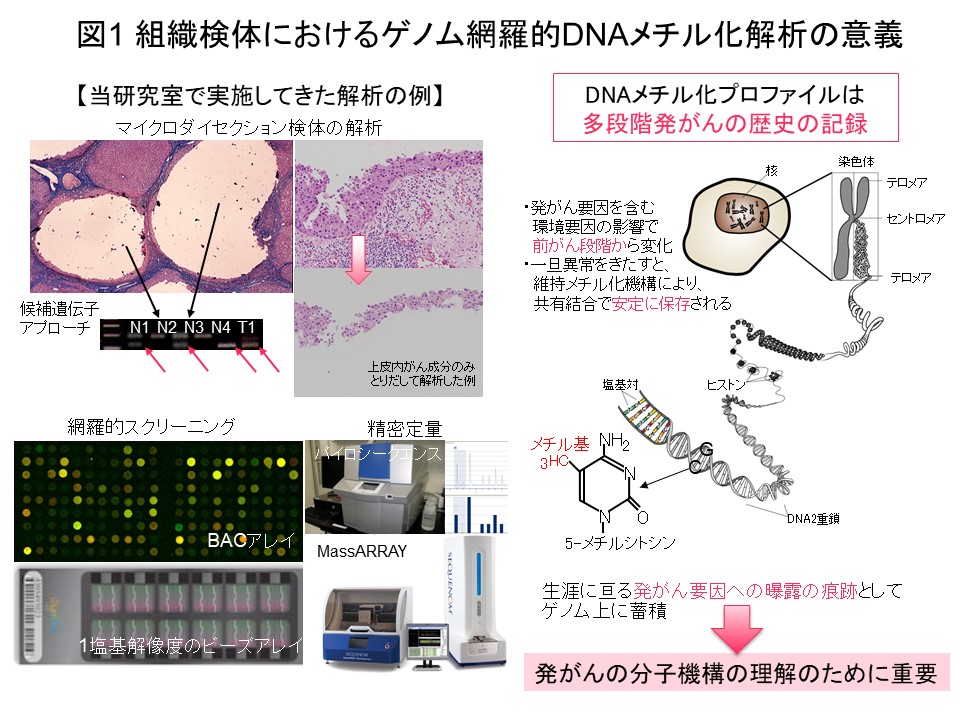
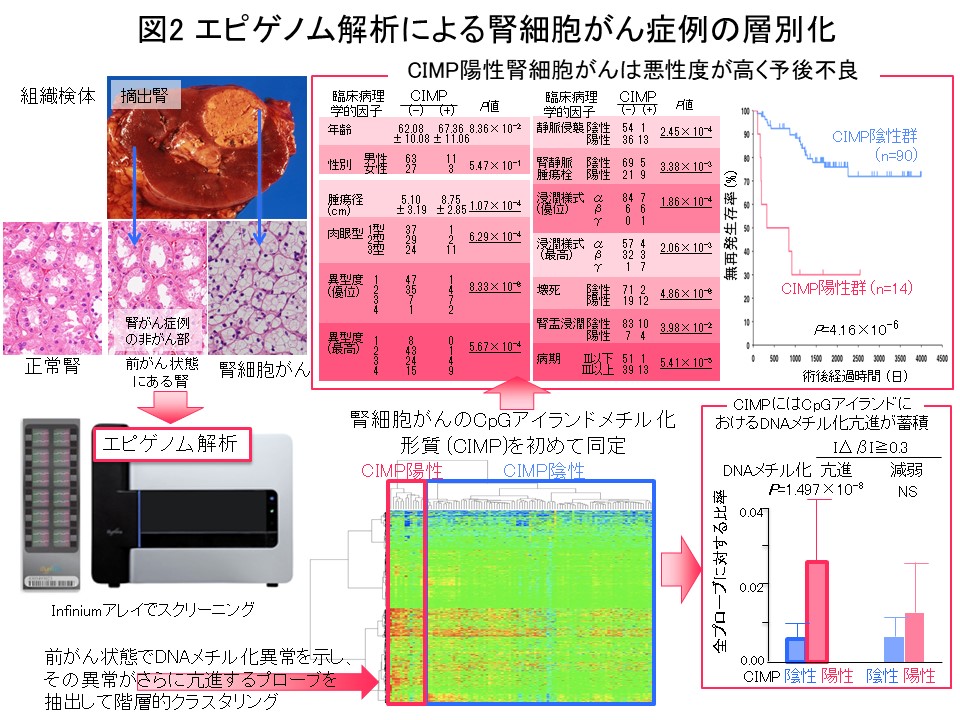
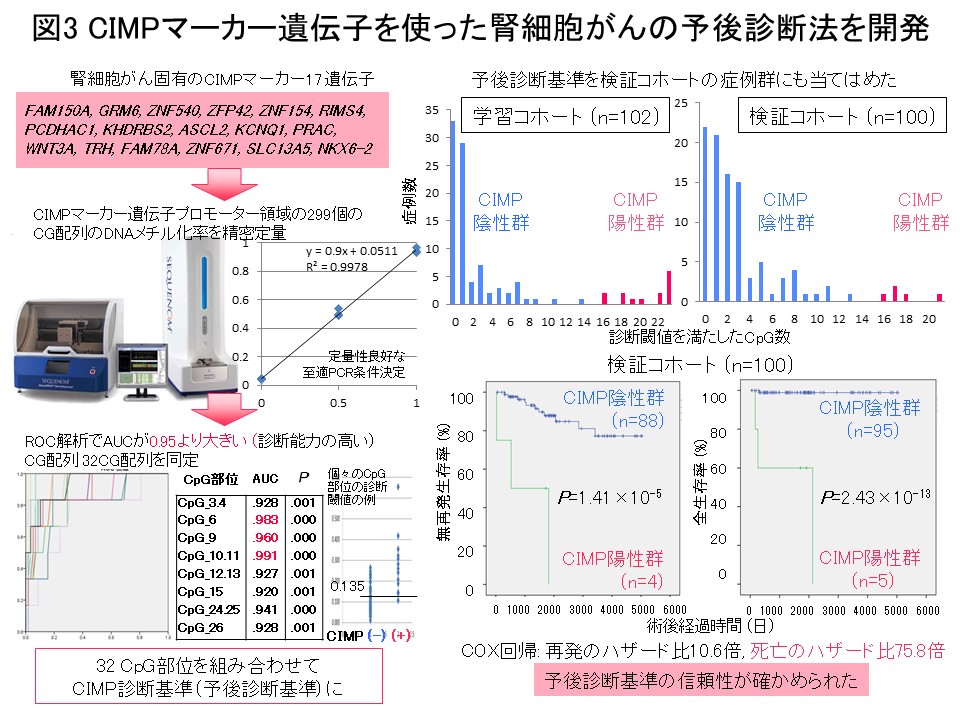
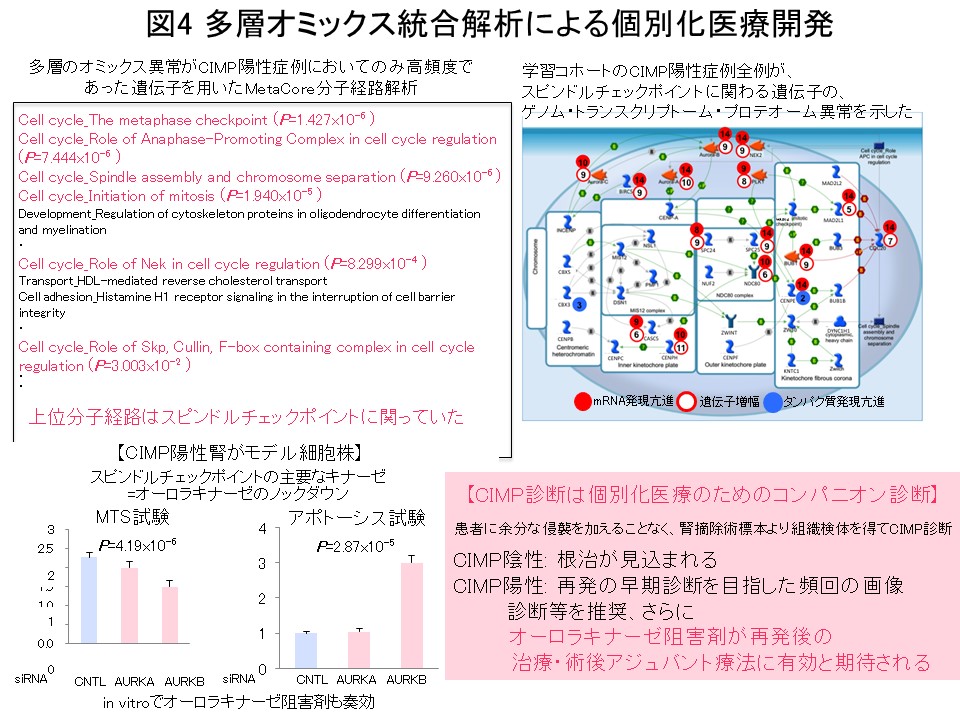
“多段階発がんの歴史の記録”であるエピゲノムプロファイルに基づいてがん症例をまず層別化し、層別化した症例群毎にゲノム・トランスクリプトーム・プロテオーム・メタボローム等の多層オミックスの解析結果をすべて統合して発がんの分子機構を探索することは、理にかなっていると考えます。そのような考えで金井は、医薬基盤研究所先駆的医薬品・医療機器研究発掘支援事業「多層的疾患オミックス解析に基づく創薬標的の網羅的探索を目指した研究」(2010-2014年度)を、エピゲノム領域の総括研究代表者として実施してきました。腎細胞がんにおける解析では、前がん段階から異常を来すエピゲノムプロファイルに基づいて、予後不良であるCpGアイランドメチル化形質 (CIMP) 陽性症例を同定し (図2) (Carcinogenesis, 33: 1487, 2012)、腎細胞がん固有のCIMPマーカー遺伝子を同定し、CIMPマーカー遺伝子のDNAメチル化定量により予後不良であるCIMP陽性症例を再現性を持って診断するためのCIMP診断基準を開発致しました (図3) (BMC Cancer, 14: 772, 2014)。さらに、多層オミックス統合解析でオーロラキナーゼがCIMP陽性症例の治療標的になることを示しました (図4) (Int J Cancer, 137: 2589, 2015)。このプロジェクトの成果は、「多層的疾患オミックス統合データベース」(http://gemdbj.ncc.go.jp/omics/)として公開しています。
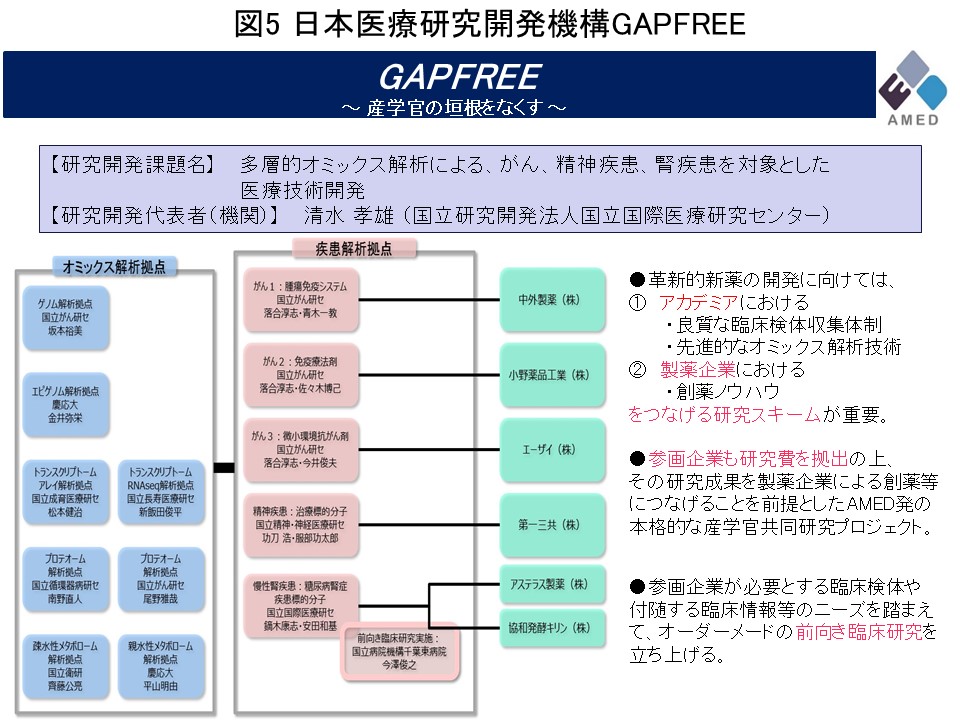
この多層的疾患オミックス解析は、日本医療研究開発機構創薬基盤研究推進事業GAPFREE (Funding for research to expedite effective drug discovery by Government, Academia and Private partnership)に継承され、当研究室は引き続きエピゲノム解析拠点を担当しています。産学官連携研究により、疾患拠点にエピゲノムデータを提供することにより、がん・腎疾患・精神疾患の創薬標的同定に貢献しています (図5)。
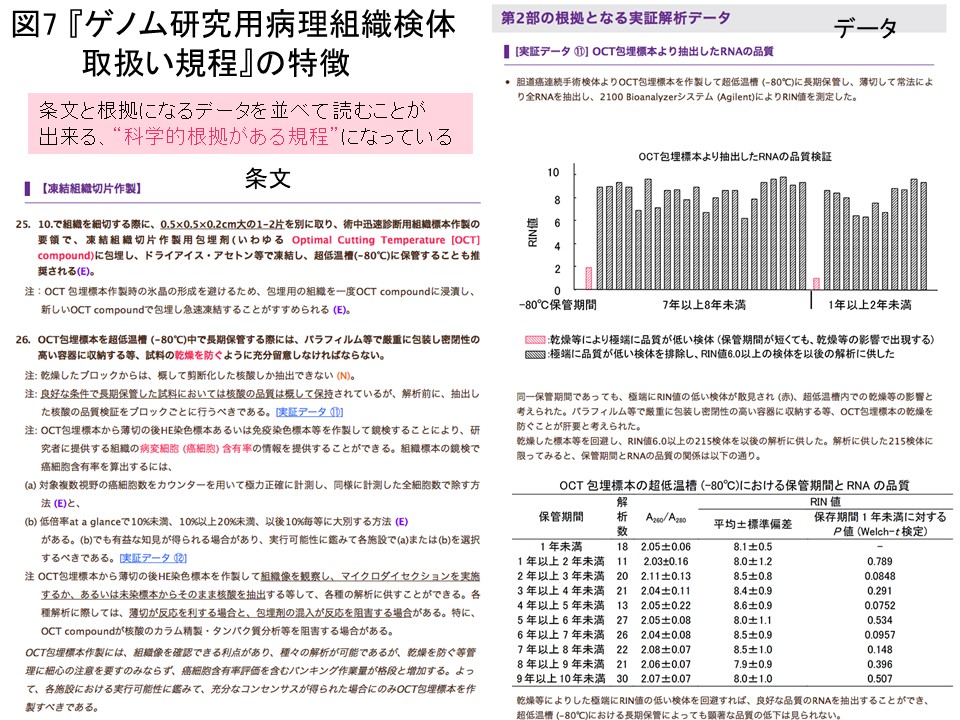
病理組織検体を使ったゲノム等オミックス解析研究を成功させるためには、適切に採取された質の高い組織検体を用いることが大切です。そこで一般社団法人日本病理学会においては、文部科学省と日本医療研究開発機構の支援を受けて、全国の大学・医療機関・バイオバンク等で研究に適した質の高い病理組織検体を充分数収集できるようにするために、適切な組織検体の採取・保管・移送方法を定めた『ゲノム研究用病理組織検体取扱い規程』 (http://pathology.or.jp/genome/)を策定することに致しました。金井は、日本病理学会ゲノム病理組織取扱い規約委員会委員長として、同委員会の委員である日本病理学会の研究者と協力し、規程の策定を行いました。特に、この規程の第2部と第3部 は、実際にいろいろな方法や条件で組織の保管や標本作成を行い、実証的に解析を行ったデータをもとに作成致しました。
規程の冊子11,000部を全国に発送し、webページで規程の全文を公開致しました。webページ上にはe-ラーニングシステム (http://pathology.or.jp/genome/e-Learning/)を設けています。全国で開催する講習会においても、規程の解説をしてきました (図6)。この規程は、条文と、条文の根拠となった実証解析データを並べて読むことができる“科学的な根拠を持つ規程”となるように編集しました (図7)。規定の英文版をPathology International誌より刊行致しました (68: 63, 2018)。今後も、新規に普及する解析手技に対応できるように実証解析を追加し、規程の改訂を継続して参ります。全国の大学・医療機関等における病理医・臨床医・臨床検査技師・バイオバンク実務者そしてゲノム研究者の方々に、本規程についてよく知っていただきご活用頂きたいと考えています。

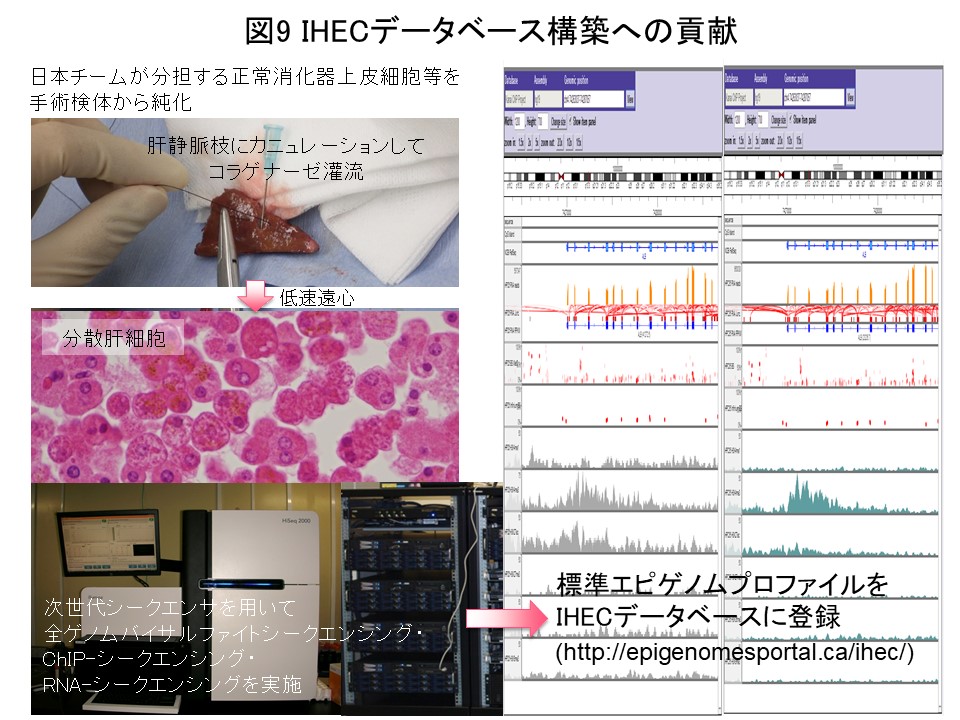
DNAメチル化とヒストン修飾パターンよりなるエピゲノム情報には組織・細胞特異的なあるいは人種・環境要因に基づく多様性があります。エピゲノムの多様性を把握し、世界共通の研究基盤としてのエピゲノムデータベースを構築するため、IHEC (http://www.ihec-epigenomes.org/) が創設されました。当研究室は、日本医療研究開発機構CREST研究事業の支援を受け、我が国の代表研究チームとしてIHECに参画しています (図8)。国立がん研究センター・九州大学・東京大学の研究者と共同し、日本人の手術検体より採取した肝・大腸・胃・腎の正常上皮細胞等において、次世代シークエンサを用い全ゲノムバイサルファイトシークエンシング・クロマチン免疫沈降 (ChIP)-シークエンシング・RNA-シークエンシング等を実施しています (図9)。結果をナショナルバイオサイエンスデータベースセンター (NBDC)( https://humandbs.biosciencedbc.jp)ならびにIHECデータポータル (http://epigenomesportal.ca/ihec/)から公開して、国際貢献を果たしました。金井はIHEC生物倫理専門委員会の委員を務めており、“IHEC Science Day & Annual Meeting 2015”をCREST/IHECの金井の研究チームと日本医療研究開発機構が東京で共催致しました (図10)。

IHECで取得したデータに基づき、各人のDNAメチル化率に個体差を認める領域 (personal differentially methylated region [pDMR])を同定したところ、遺伝子多型部位の近傍に有意に高頻度にpDMRを観察致しました。ゲノムの多型がcisに働いてエピゲノム多型を誘導し、遺伝子発現の個体差を介して、表現型の個体差や疾患への易罹患性を創出する場合があると考えています (図11) (Epigenomics, 10: 955, 2018)。IHECデータベースに登録された正常細胞等の標準エピゲノムプロファイルと比較することで、疾患特異的エピゲノムプロファイルを同定し、がん等の本態を解明しバイオマーカーを開発する研究に、引き続き役立てたいと考えています。
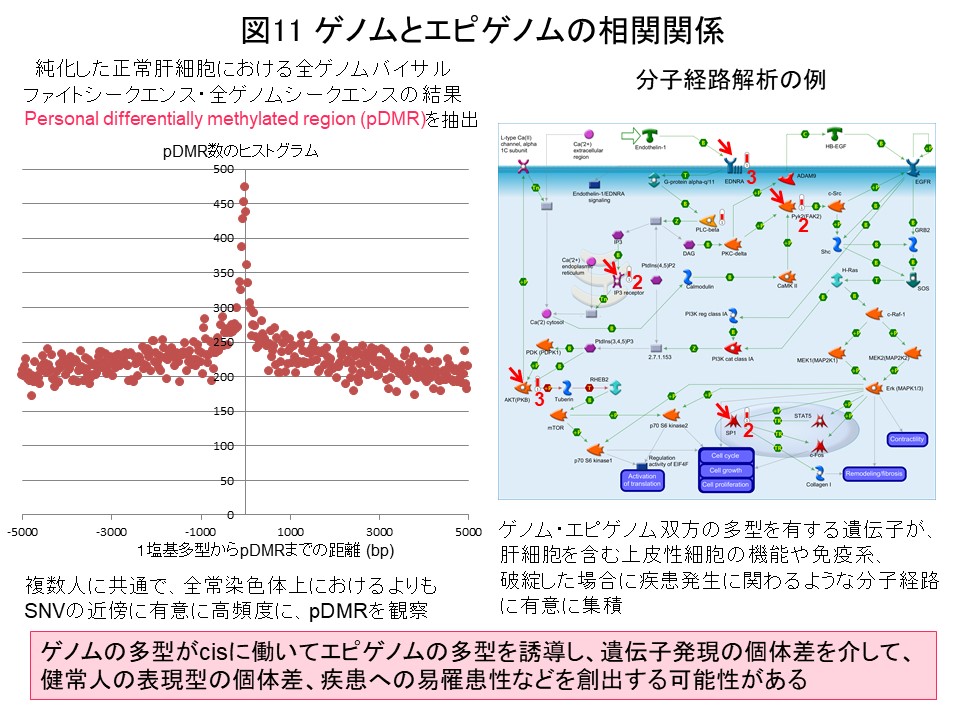
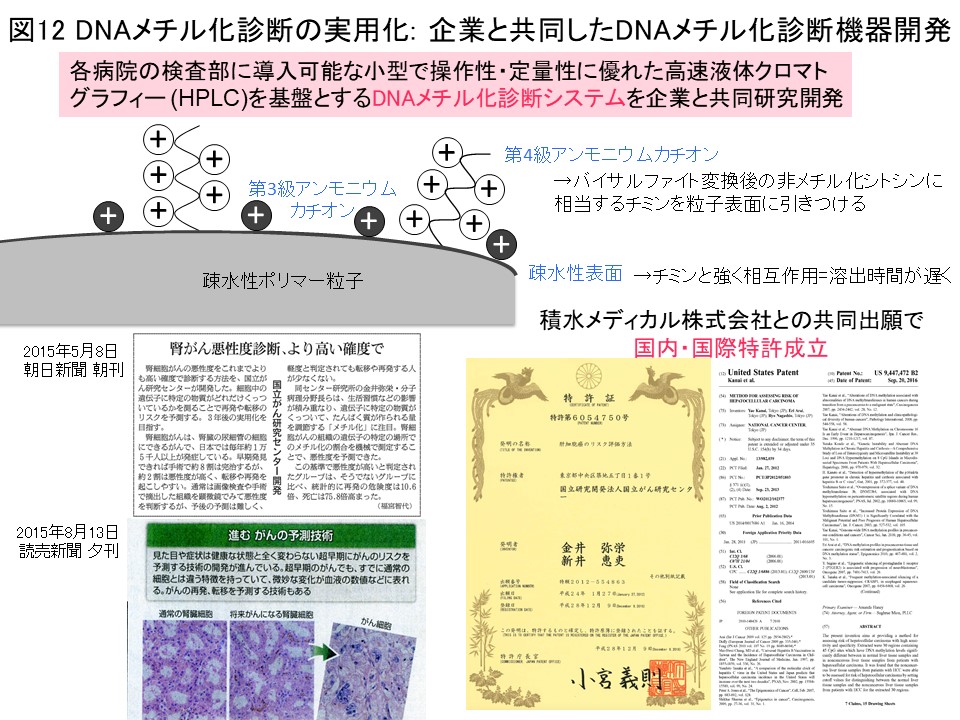
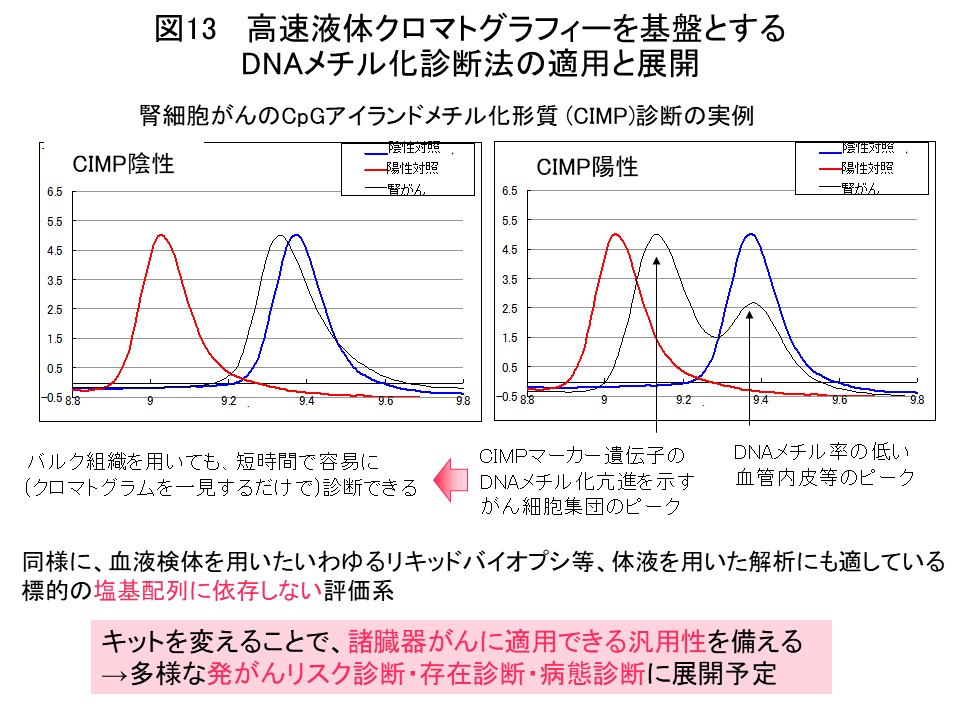
図3で同定した腎細胞がん固有のCIMPマーカー遺伝子のDNAメチル化率を用いると、腎細胞がんの予後診断・CIMP陽性腎細胞がんの術後アジュバント療法のためのコンパニオン診断 (図4)を行いうると期待されます。このようなDNAメチル化診断を実用化するため、各病院の検査部にも導入可能な小型で操作性・定量性に優れたHPLCを基盤とする「DNAメチル化診断機器」を積水メディカル株式会社つくば研究所と共同研究開発を致しました (Cancer Sci, 109: 1690, 2018)。過日、本件のプレスリリースを行い (https://www.ncc.go.jp/jp/information/pr_release/2015/0317/index.html)、全国紙を含む複数のメディアで報道されました (図12)。国内・国際特許も成立しております (図12)。私達が開発したHPLCカラムにはアンモニウムカチオンと疎水性粒子よりなる充填剤を含みます。バイサルファイト変換後の非メチル化シトシンに相当するチミンの方が、カラム充填剤と強く相互作用するため溶出時間は遅くなり、DNAメチル化率を精密に定量できます (図12)。この原理を用いた、腎細胞がんのCIMP診断の例を図13に示しています。バルクの組織を用いても、DNAメチル率の低い血管内皮等のピークと、CIMPマーカー遺伝子のDNAメチル化亢進を示すがん細胞の集団が存在することを、短時間で容易にクロマトグラムを一見するだけで知ることができます。キットを替えることで、諸臓器がんの発がんリスク診断・存在診断・病態診断、血液検体を用いたいわゆるリキッドバイオプシに展開していく予定です。
私達は、がんなどの病気の本態の理解を進め臨床の役に立つ研究成果を上げるために、多様な臨床病理像を示す多数の症例の多数の病理組織検体でゲノム網羅的DNAメチル化解析を進めたいといつも考えています。この時、次世代シークエンサを使った方法では多数の検体を調べきれないので、多数検体に適用可能でありながら十分な量の情報が得られる (1CpG部位ごとにゲノム中の87か所程度のCpG部位のメチル化率を正確に調べられる) 優れたスクリーニング法である、高密度ビーズアレイを使った解析を採用しています。
私達はいろいろな臓器における前がん段階に興味を持っています。例えば、慢性胃炎やヘリコバクター感染を伴う胃粘膜は胃がんに対する前がん段階にある可能性があります。そこで、非がん胃粘膜のDNAメチル化状態を基に、胃がん症例の層別化 (グループ分け)をしたところ、悪性度が相互に異なるような胃がんのグループができました (Carcinogenesis, 36: 509, 2015)。前がん段階で成立したDNAメチル化プロファイルががんに継承され、悪性度や予後を規定していると考えています。肺腺がん症例から得られた非がん肺組織にも、喫煙・慢性閉塞性肺疾患といった発がんの背景要因に呼応するDNAメチル化プロファイルが成立していました (Int J Cancer, 135: 319, 2014)。驚くべきことに、肺腺がん組織そのもののDNAメチル化プロファイルよりも、前がん段階 (非がん肺組織)のDNAメチル化プロファイルの方が、症例の予後を強く運命づけていることが分かりました (PLoS One, 8: e59444, 2013)。腎盂・尿管・膀胱にできる尿路上皮がんは時間的・空間的に多発するという臨床的特徴を持っています。これは、腎盂・尿管・膀胱 (全尿路)の尿路上皮が、尿中の発がん物質等に継続して曝露し、全尿路で発がんのリスクが高まった前がん段階に達するためと考えられます。そこで、尿路上皮がんの発生を予防したり早期に診断できるようにするために、尿検体で前がん段階のDNAメチル化異常を検出する発がんリスク診断基準を開発しました。他方では、諸臓器がんの早期再発等を予測する悪性度診断基準も開発しています。
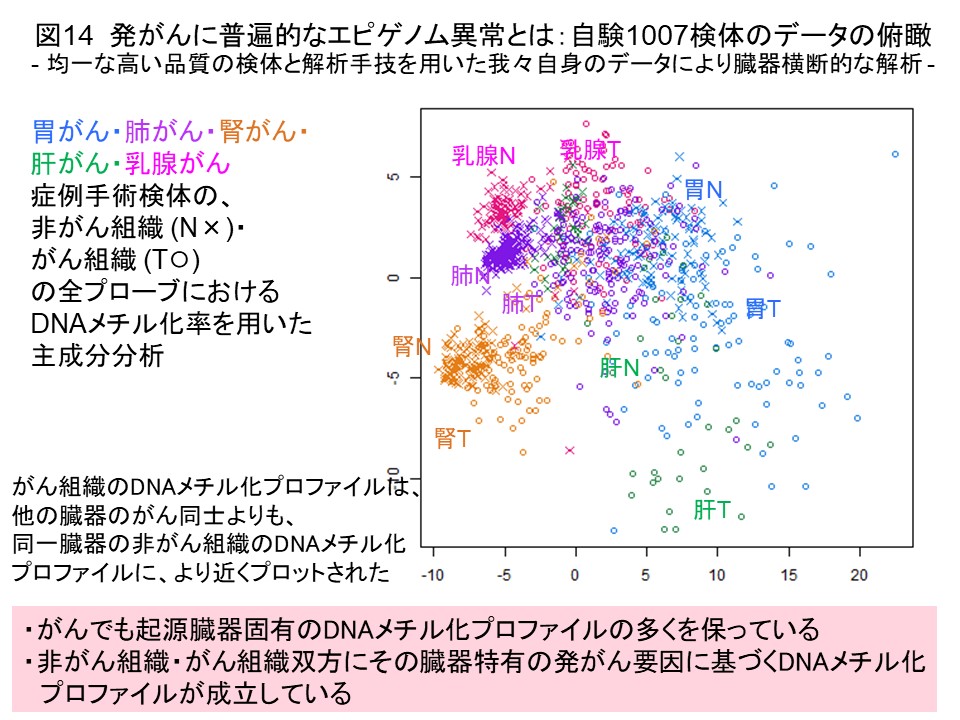
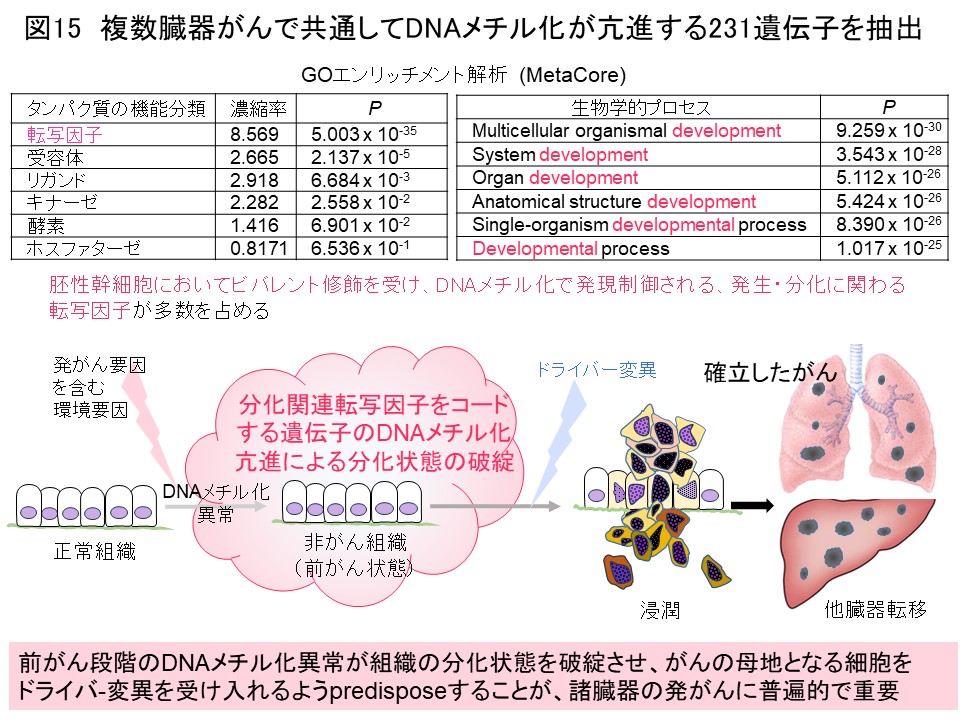
このようにして、諸臓器がんのDNAメチル化プロファイルの解析を蓄積してまいりましたので、発がんに普遍的なDNAメチル化異常の理解を進めるため、私達自身で解析した1000検体以上のデータを臓器横断的に比較しました。すると、ある臓器のがん組織のDNAメチル化プロファイルは他の臓器のがん同士よりも、同一臓器の非がん組織のDNAメチル化プロファイルに似ていることがわかりました (図14) (Carcinogenesis, 38: 241, 2017)。がんでもその臓器固有のDNAメチル化プロファイルを保っているか、非がん組織とがん組織の両方にその臓器特有の発がん要因に基づくDNAメチル化プロファイルが成立していることが示唆されました。そして、複数臓器がんで共通してDNAメチル化異常を示す遺伝子の多くは、DNAメチル化で発現制御されることが報告されている、発生・分化に関わる転写因子をコードしていました (図15) (Carcinogenesis, 38: 241, 2017)。前がん段階においてこれらの遺伝子のDNAメチル化異常が起き、細胞や組織の分化状態が破綻することで、がんの母地となる細胞がドライバー変異と呼ばれるジェネティックな異常を受け入れ易くなっていることが発がんに重要と考えました。
当研究室では、肝炎ウイルス感染による前がん段階である慢性肝炎・肝硬変症の段階におけるDNAメチル化異常をいち早く報告して以来 (Jpn J Cancer Res, 87: 1210, 1996)、前がん段階から肝細胞がんに至るまでの過程におけるDNAメチル化異常の寄与に注目してきました。肝炎ウイルス関連肝細胞がんの発生過程で、DNAメチル化異常が染色体不安定性に先行すること (Hepatology, 32: 970, 2000)、DNAメチル化酵素の発現 (Int J Cancer, 105: 527, 2003)やプライス (Proc Natl Acad Sci USA, 99:10060, 2002)の異常がDNAメチル化異常を誘導することを示し、肝発がんリスク診断基準 (Int J Cancer, 129: 1170, 2011)・予後診断基準 (Int J Cancer, 125: 2854, 2009)を開発してきました。
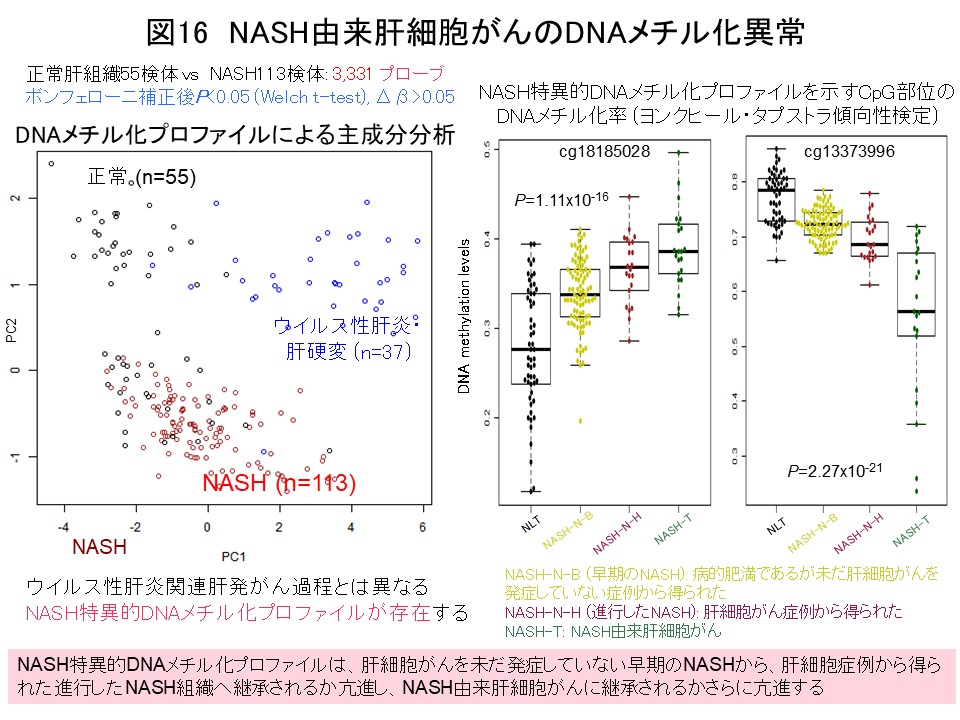
現在は、近年急増している非アルコール性脂肪性肝炎 (non-alcoholic steatohepatitis [NASH])由来肝細胞がんに注目しています。NASHの病態では、正常肝組織とも肝炎ウイルス感染を伴う慢性肝炎・肝硬変症を呈する肝組織とも異なる、NASH特異的DNAメチル化プロフファイルが成立していることがわかりました (Carcinogenesis, 38: 261, 2017)。NASH特異的DNAメチル化異常は、未だ肝細胞がんを発症していないNASHから、すでに肝細胞がんを発症したNASHへと段階的に亢進し、さらにNASH由来肝細胞がんに継承されることがわかりました (図16)。ヒストンメチルトランスフェラーゼWHSC1は、NASH特異的DNAメチル化異常を示すNASH由来肝細胞がんの治療標的候補と考えています (Carcinogenesis, 38: 261, 2017)。現在は、NASH由来肝細胞がんにおいてDNAメチル化異常により安定した遺伝子発現異常に帰結する可能性のあるがん関連遺伝子の同定をさらに進め、DNAメチル化プロファイルと臨床病理像に基づくNASH由来肝細胞がんの層別化を行っています。さらに、NASHからの肝発がんリスク指標開発は、アンメットメディカルニーズの一つと考え、早期の実用化を目指し精力的に取り組んでいます。
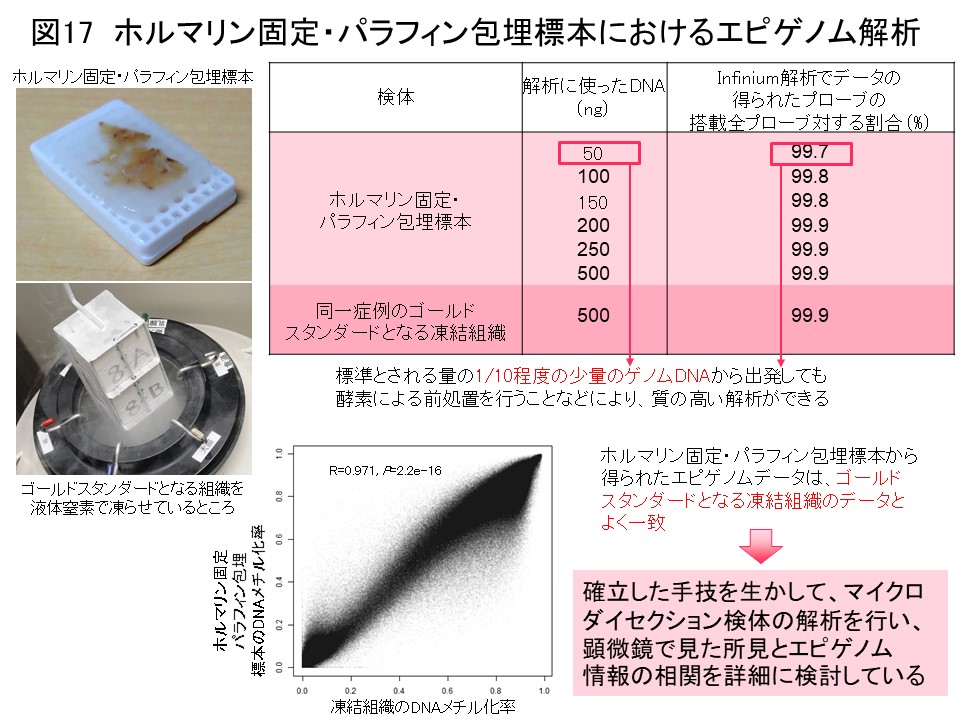
エピゲノム情報はゲノム情報に比べて可塑性が高く、DNAメチル化異常はがん細胞の周りの微小環境に応じて比較的容易に引き起こされるので、私達が顕微鏡で観察しているがんの組織学的な多様性は、遺伝子変異よりもむしろDNAメチル化異常によって説明できます。DNAメチル化異常と組織学的多様性をより厳密に対応させるためには、がん組織の中のがん細胞の顔つきが悪くなったり構築が崩れたりするのを顕微鏡で観察したまさにその領域で、ゲノム網羅的DNAメチル化解析を行う必要があります。ホルマリン固定パラフィン包埋標本を顕微鏡で見ながら、そのような領域をレーザーで切り抜いたものを、マイクロダイセクション検体と言います。ホルマリン固定パラフィン包埋の過程でDNAが壊れてしまうので、従来マイクロダイセクション検体においてこのような解析を行うことは困難でした。そこで私達は、ゲノムDNAを酵素的に修復して、ゲノム網羅的DNAメチル化解析を、マイクロダイセクション検体より抽出した微量のDNAでも実施できるようにしました (図17) (Pathol Int, 68: 633, 2018)。
解析手技を確立したので、現在は、一人の患者さんの病変の間にも表在性乳頭状がん・広汎進展上皮内がん・結節状浸潤がんなど多彩な組織像が見られる尿路上皮がん症例から、多数のマイクロダイセクション検体を採取して解析を進めています。一人の患者さんの病変の中に、腫瘍血管の密度が異なる領域や壊死巣が分布し、がんの各所の微小環境がさまざまである脳の膠芽腫症例からも、マイクロダイセクション検体を採取しています。腎細胞がんの同一症例からも、細胞の顔つきの悪さの異なる複数の領域からマイクロダイセクション検体を採取します。今まで私達はゲノム・エピゲノム・トランスクリプトーム・プロテオーム・メタボロームといった多層オミックス統合解析を行ってきましたが、最近新しいオミックスの層として、タンパク質に結合する糖鎖のパターンを網羅的に解析するグライコプロテオーム解析も導入しています。マイクロダイセクション検体でエピゲノム・グライコプロテオーム情報を同時に取得して、がんの性質を決定する分子のさらなる同定を目指しています。
私たちの体は細胞と細胞間物質から構成されており、細胞の機能は細胞外マトリックスや生理活性物質からなる細胞間組織内微小環境因子によって規定されています。これらの組織内微小環境因子は、正常組織では恒常性維持に働く一方で、病的状態ではプロテアーゼなどの酵素により分解され、組織の破壊・再生に関与することが知られています。我々は主にMMP(Matrix metalloproteinase)やADAM(A disintegrin and metalloproteinase)といったメタロプロテアーゼに着目し、がんをはじめとするさまざまな疾患の発症・進展機序の解析を行っています。MMPは1960年代にオタマジャクシの尾が吸収される過程に関わる酵素として発見され、その後がんやリウマチなどさまざまな疾患での組織破壊に関与していることがわかっています。一方、ADAMは蛇毒メタロプロテアーゼに類似したMMP近縁遺伝子ファミリーで、MMPと同様に細胞外マトリックスや生理活性物質の代謝に関わるほか、膜タンパクのsheddingにおいても重要な役割を果たすことが知られています。
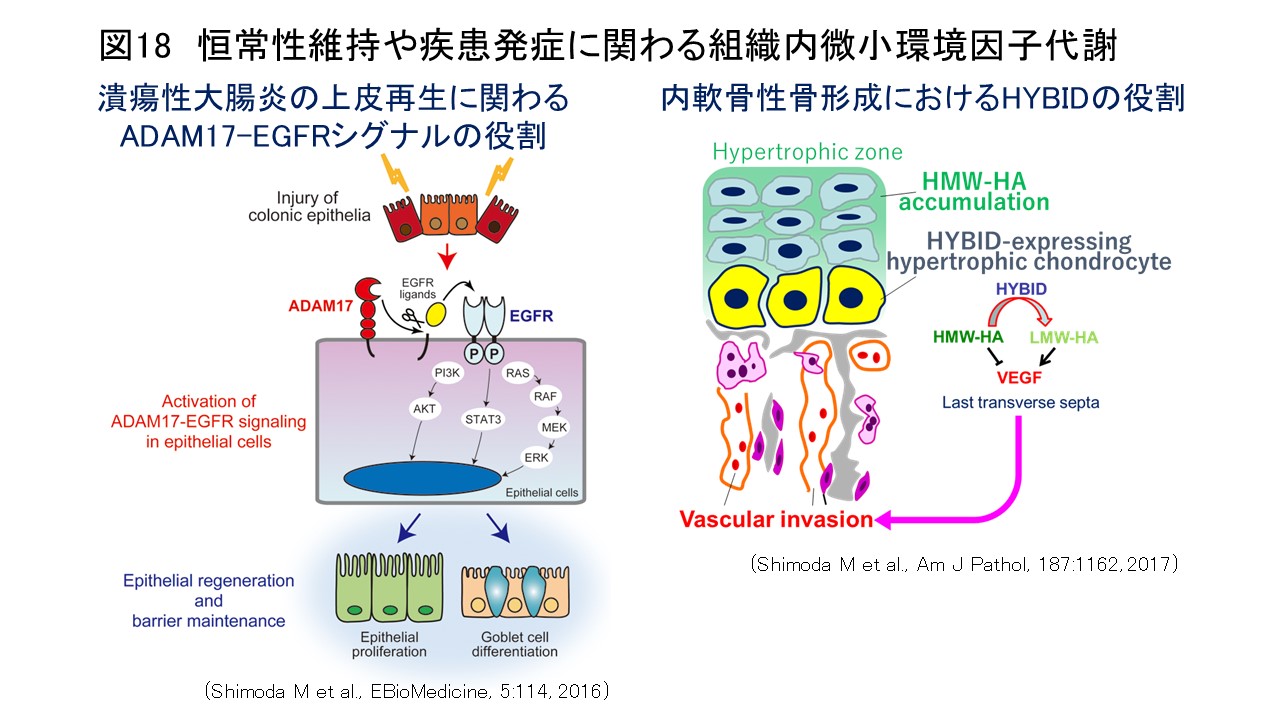
我々はこれまでに、ADAM28がヒトがん細胞選択的に高発現し、がん細胞の増殖・転移と有意に相関することを示すとともに(Int J Cancer, 118:263, 2006; Cancer Res, 66:9913, 2006)、細胞接着・運動・浸潤能促進、抗アポトーシス作用、血管新生などを介して(J Biol Chem, 282:25864, 2007; J Natl Cancer Inst, 104:906, 2012)、がん進展を促進することを明らかにしてきました。さらに、急性大動脈解離や大動脈瘤形成におけるMMP-9やADAM17の作用機構(Atherosclerosis, 218:470, 2011; Circulation, 126:3070, 2012; Circ Res, 116:612, 2015)、筋再生におけるADAM10の役割(J Biol Chem, 290:28456, 2015)、潰瘍性大腸炎の上皮再生に関わるADAM17-EGFRシグナルの役割(EBioMedicine, 5:114, 2016)、骨格形成や変形性関節症におけるHYBID(HYaluronan-Binding protein Involved in hyaluronan Depolymerization)を介した新規ヒアルロン分解系の役割(Am J Pathol, 187:1162, 2017; Am J Pathol, 188:2109, 2018)を報告し(図18)、プロテアーゼを介した組織内微小環境因子代謝が腫瘍形成・進展や炎症性疾患発症に深く関与していることを明らかにしてきました。現在、これらの研究成果を基に、企業と共同でADAM28を標的とした肺がん分子標的医薬の開発を進めるとともに、遺伝子改変マウスなどを用いて病的組織における組織内微小環境因子代謝メカニズムの解明に取り組んでいます。
がん関連線維芽細胞(cancer-associated fibroblast: CAF)はがん間質の主要な構成成分であり、種々のがん組織において、CAFの存在ががんの悪性度と相関することが報告されています。また、がん細胞とCAFとの共培養やマウスへの移植モデルを用いた研究により、実験的にもCAFががん細胞の増殖・浸潤、がん幹細胞維持、血管新生などを促進することが実証されているほか(Semin Cell Dev Biol, 21:19, 2010)(図19)、最近の研究からCAFががん細胞の化学療法や放射線治療に対する抵抗性を強めることも明らかとなってきました。これらの研究からCAFはがんの新たな治療標的として注目されていますが、一方で、不均一な細胞集団であるCAFには複数のマーカーが報告されており(J Exp Med, 211:1503, 2014)、現在のところ治療標的とするべき特定のCAF細胞集団の同定やその制御機構についてはわかっていない部分が多く、CAFを標的とした治療薬の開発は進んでいないのが現状です。
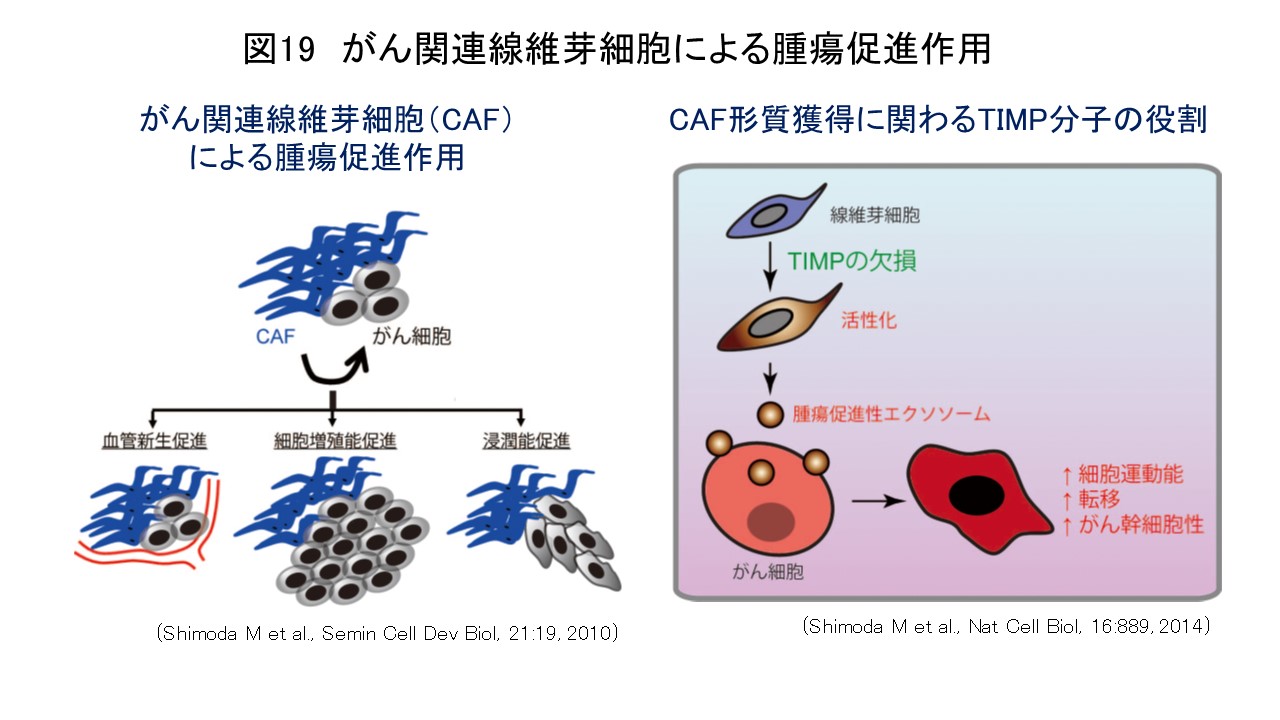
近年我々はTIMP (tissue inhibitor of metalloproteinases)という分子がCAFの機能を抑制していることを明らかにしました。TIMPはメタロプロテアーゼの内因性阻害分子で、がん組織においてはメタロプロテアーゼとTIMPのバランスが崩れることにより腫瘍内微小環境が大きく変化することが知られています。この研究では、TIMP欠損線維芽細胞がメタロプロテアーゼ活性依存性に腫瘍促進性CAF形質を獲得することを見出しました。また、CAFががん細胞に作用する際の新たな細胞間コミュニケーション媒体としてエクソソーム(exosome)を同定し、線維芽細胞由来エクソソームががん細胞の運動能亢進やがん幹細胞維持に関与していることを報告しました(Nat Cell Biol, 16:889, 2014; Biochim Biophys Acta Mol Cell Res, 1864:1989, 2017)(図19)。最近がん間質における遺伝子発現パターンが独立した予後予測因子となりうることが報告され、がん間質からのシグナルが直接的あるいは間接的にがん細胞に影響を及ぼし、腫瘍の進展に積極的に関与していることが推測されています。また、遺伝的異常の頻度が高く、薬剤耐性を獲得しやすいがん細胞に比較して、間質を標的とした治療は治療抵抗性を生じにくいとも考えられます。現在、我々はオミックス解析技術などを取り入れ、治療標的となりうるCAF細胞集団の特性やがん細胞・免疫細胞との相互作用機序の解明に取り組み、がん間質を標的とした新たな治療戦略確立を目指しています。
